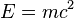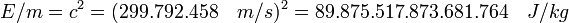Evolución de la ciencia
Los esfuerzos para sistematizar el conocimiento se remontan a los tiempos prehistóricos, como atestiguan los dibujos que los pueblos del paleolítico pintaban en las paredes de las cuevas, los datos numéricos grabados en hueso o piedra o los objetos fabricados por las civilizaciones del neolítico.}
La ciencia moderna Esencialmente, los métodos y resultados científicos modernos aparecieron en el siglo XVII gracias al éxito de Galileo al combinar las funciones de erudito y artesano. A los métodos antiguos de inducción y deducción, Galileo añadió la verificación sistemática a través de experimentos planificados, en los que empleó instrumentos científicos de invención reciente como el telescopio, el microscopio o el termómetro. A finales del siglo XVII se amplió la experimentación: el matemático y físico Evangelista Torricelli empleó el barómetro; el matemático, físico y astrónomo holandés Christiaan Huygens usó el reloj de péndulo; el físico y químico británico Robert Boyle y el físico alemán Otto von Guericke utilizaron la bomba de vacío.
La ciencia en España y Latinoamérica
Los comienzos de la ciencia española se remontan (dejando aparte el primitivo saber de san Isidoro de Sevilla) a la civilización hispanoárabe y sobre todo a la gran escuela astronómica de Toledo del siglo XI encabezada por al-Zarqalluh (conocido por Azarquiel en la España medieval).
Comunicación científica
A lo largo de la historia el conocimiento científico se ha transmitido fundamentalmente a través de documentos escritos, algunos de los cuales tienen una antigüedad de más de 4.000 años. Sin embargo, de la antigua Grecia no se conserva ninguna obra científica sustancial del periodo anterior a los Elementos del geómetra Euclides (alrededor del 300 a.C.). De los tratados posteriores escritos por científicos griegos destacados sólo se conservan aproximadamente la mitad.
Campos de la ciencia
Originalmente el conocimiento de la naturaleza era en gran medida la observación e interrelación de todas las experiencias, sin establecer divisiones. Los eruditos pitagóricos sólo distinguían cuatro ciencias: aritmética, geometría, música y astronomía. En la época de Aristóteles, sin embargo, ya se reconocían otros campos: mecánica, óptica, física, meteorología, zoología y botánica. La química permaneció fuera de la corriente principal de la ciencia hasta la época de Robert Boyle, en el siglo XVII, y la geología sólo alcanzó la categoría de ciencia en el siglo XVIII. Para entonces el estudio del calor, el magnetismo y la electricidad se había convertido en una parte de la física. Durante el siglo XIX los científicos reconocieron que las matemáticas puras se distinguían de las otras ciencias por ser una lógica de relaciones cuya estructura no depende de las leyes de la naturaleza. Sin embargo, su aplicación a la elaboración de teorías científicas ha hecho que se las siga clasificando como ciencia.Las ciencias naturales puras suelen dividirse en ciencias físicas y químicas, y ciencias de la vida y de la Tierra. Las principales ramas del primer grupo son la física, la astronomía y la química, que a su vez se pueden subdividir en campos como la mecánica o la cosmología. Entre las ciencias de la vida se encuentran la botánica y la zoología; algunas subdivisiones de estas ciencias son la fisiología, la anatomía o la microbiología. La geología es una rama de las ciencias de la Tierra.
http://html.rincondelvago.com/evolucion-de-la-ciencia.html